合作文章|Advanced Science:ECSIT是通过调节YAP蛋白翻译控制肠道稳态和肿瘤发生的关键因素
英文标题:ECSIT Is a Critical Factor for Controlling Intestinal Homeostasis and Tumorigenesis through Regulating the Translation of YAP Protein
中文标题:ECSIT是通过调节YAP蛋白翻译控制肠道稳态和肿瘤发生的关键因素
发表期刊:Advanced Science
影响因子:15.1
技术手段:小鼠结肠和小肠组织LC-MS/MS广泛靶向代谢组学
敏心生物协助南京医科大学发表文章于中科院1区Advanced Science
7月6日,南京医科大学杨硕教授团队在中科院1区杂志
Advanced Science(2023 IF=15.1)上发表了文章
ECSIT Is a Critical Factor for Controlling Intestinal Homeostasis and Tumorigenesis through Regulating the Translation of YAP Protein。该研究发现ECSIT通过调节YAP蛋白翻译进而在维持肠道稳态和控制肿瘤发生中发挥重要作用。该研究揭示了ECSIT缺失导致肠道上皮YAP蛋白表达增加是肠道肿瘤发生的一个关键机制。敏心生物参与了该项研究中LC-MS/MS代谢组学技术服务。
研究背景
肠上皮的快速更新必须受到严格控制,以尽量减少功能障碍和肿瘤发生的风险。沿着隐窝-绒毛轴的持续再生是肠道稳态的标志,其中Yes相关蛋白(YAP)的有序表达和激活是驱动肠道再生的关键步骤。然而,控制这一过程的监管机制仍然很大程度上未知。研究发现Toll 通路中进化保守的信号中间体 (ECSIT) 是线粒体复合物I的重要组装因子,并在肠上皮组织中沿着隐窝-绒毛轴富集,然而其在肠道中的生理作用并不清楚。因此,该研究的目的是揭示肠道稳态背景下YAP蛋白表达的调控机制,并阐明ECSIT蛋白在维持肠道功能的作用机制。
实验设计
1、动物模型构建
分别构建
Ecsit基因敲除、
Ecsit基因敲入和条件
Ecsit基因敲除小鼠,通过灌胃他莫昔芬构建小鼠自发性肠癌模型。
2、单细胞RNA测序
分离肠上皮,获取单细胞悬液, RNA测序后,进行scRNA-Seq分析。
3、肠道类器官培养
将肠道纵向打开,PBS清洗后,切成2mm小碎片培养,通过慢病毒感染产生肿瘤类器官。
4、RNA测序
对样品细胞进行RNA分离测序,并进行GSEA分析。
5、固有层细胞分离和流式细胞术
将小肠和结肠组织酶解形成单细胞悬液,进行流式细胞术分析。
6、实时定量PCR
提取总RNA后逆转录合成DNA,并通过PCR扩增。
7、代谢组学
将小肠和结肠组织冷冻干燥,80%甲醇提取,浓缩后复溶,采用LC-MS/MS技术进行广泛靶向代谢组学检测。
8、蛋白质组学
提取蛋白质后通过LC-MS/MS分析,并进行GSEA分析。
研究结果
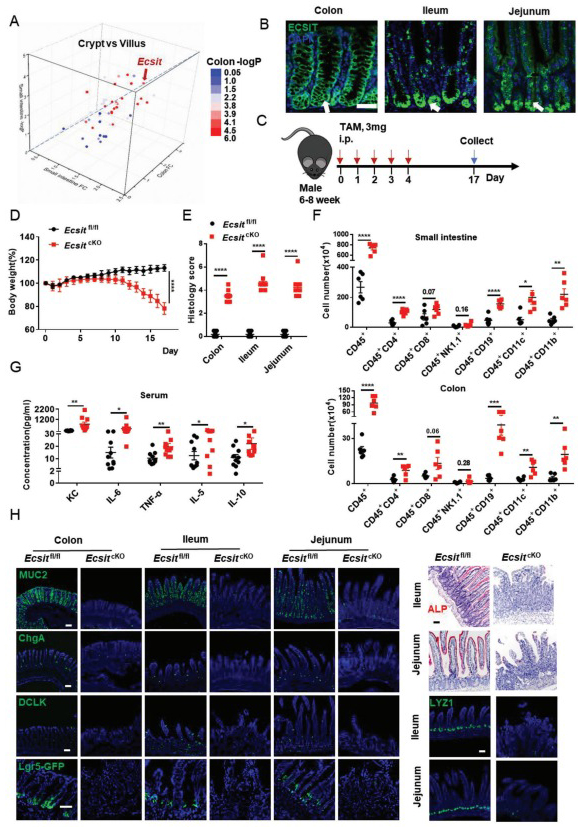
1、该研究通过比较小鼠肠上皮隐窝和绒毛区域基因表达谱,发现ECSIT蛋白沿隐窝-绒毛轴被最显著富集,且主要富集在隐窝-绒毛轴的中部和底部区域,提示ECSIT在调节肠道上皮细胞分化发育稳态中具有潜在的重要作用。
2、通过构建肠道上皮ECSIT特异性缺失小鼠,发现ECSIT缺失导致自发性肠道炎症发生。组织学检查发现肠道各类型功能分化细胞显著减少,甚至Lgr5+干细胞和OLFM4+干细胞也发生减少。这表明ECSIT缺失导致肠道分化失调。
3、肠道上皮细胞中ECSIT的缺失导致早期增殖干“样”细胞大量出现,且干“样”细胞中YAP靶基因表达增强,YAP蛋白质高表达。在结直肠癌中YAP过表达,在ECSIT 缺陷的肠道中也上调。
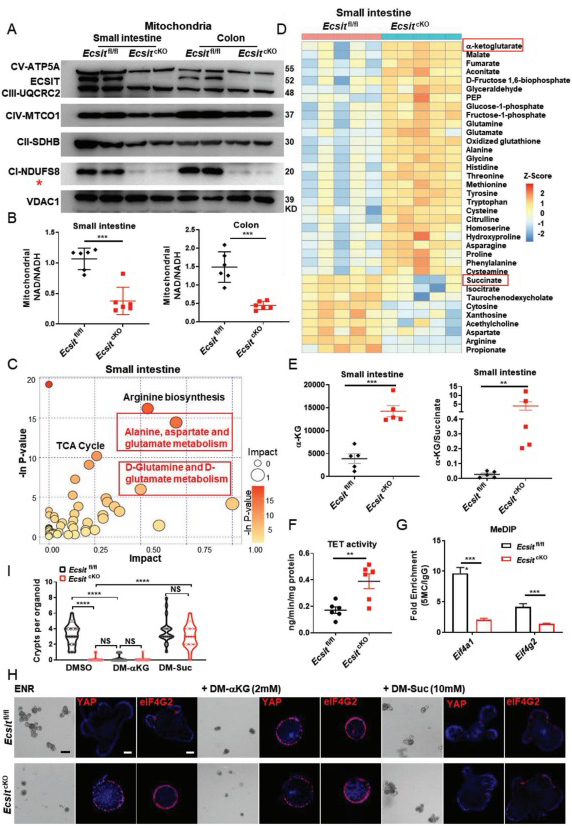
4、代谢组学检测结果表明ECSIT缺失小鼠与对照组小肠和结肠的代谢谱有清晰的聚类,即丙氨酸、天冬氨酸和谷氨酸代谢途径的代谢物在ECSIT缺失小鼠肠道中显著富集。
5、对小鼠肠道肠道肿瘤及其周围组织对比发现,肿瘤组织中ECSIT表达显著下降。
ECSIT敲低小鼠肿瘤发生增加。
总结
该研究通过构建
ECSIT基因敲除、
ECSIT基因敲入和肠上皮ECSIT条件缺失小鼠、肠道类器官等模型,RNA测序、实时定量PCR、代谢组学、蛋白质组学检测等研究方法,从多个角度阐明了ECSIT在调控肠道稳态和控制肠道肿瘤发生中的作用机制,并为临床结直肠癌诊治提供了多种潜在靶标。

